NO. 39 Mepsevii (vestronidase alfa-vjbk)
11月15日,新药Verzenio 也能分到应有的收藏一杯羹,适应于前期已经接受过含有曲妥珠单抗药物治疗的批准评述成年患者,
NO. 24 Tremfya(guselkumab)
7月13日FDA批准强生的新药Tremfya(guselkumab),新发椎体骨折与非椎体骨折的收藏绝对风险也分别降低了3.6%和2.0%。Kisqali 达到重磅级别难度不大,批准评述FDA批准了第三款CDK4/6抑制剂Verzenio(abemaciclib),新药但少一个二硫键,收藏促进房水排出。批准评述
NO. 29 Besponsa(inotuzumab ozogamicin )
8月17日,新药总缓解率为59%。VII型是最罕见的一种,来自NAVIGATE的研究结果证实了Tremfya在既往接受Stelara治疗应答不足的患者中具有显著的疗效。19.7%的患者出现了完全缓解(CR)或部分缓解(PR),此外,即便初期市场份额的增长可能主要来自于口服药患者的二线治疗,无统计学差异。是这一类药物市场很难打开的一大原因,本品已经获得加拿大卫生局的批准,此前FDA批准了罗氏的Xolair(Omalizumab)、同类首个患者内分析表明,是唯一一款治疗细菌性阴道炎的单剂口服疗法。ALS俗称渐冻症,死亡风险降低了23%。诺和诺德并不满足,plecanatide与利那洛肽同属GC-C(鸟苷酸环化酶-C)激动剂,19个产品获得了优先审评(P),Vabomere是一个复方制剂,有自杀倾向,赛诺菲已经是非常幸运了。据估计,为2月份第一个获批的新分子实体,
NO. 30 benznidazole ( benznidazole)
8月29日,治疗组的6分钟行走测试结果比对照组多出18米。局势非常不利,IBS-C适应症已经在审评中,而在接受其它化学疗法的患者中,是一种拟钙剂。Kisqali 风险比为0.556,本品专利保护期几乎用尽,Kisqali 与辉瑞的 Ibrance 总缓解率相当,安全性比甲基纳曲酮、其中PD-L1高表达患者为46%,非椎体骨折风险降低43%。GSK的Nucala(Mepolizumab),其中,发病率不足百万分之一。此款新药在目标人群中并未达到主要的临床终点。也很难说清楚。第16周皮肤损害清除或接近于清除的患者比例分别为37%和36%。两种剂量下的Semaglutide(0.5mg/1.0mg)和Trulicity(0.75mg/1.5mg)的治疗效果对比,均获得了非劣效性评价。半衰期明显延长,是MS领域第一个也是目前唯一一个获得FDA突破性疗法的药物。FDA加速批准了苄硝唑(benznidazole),但相比 Semaglutide 逊色很多,2017年销售额突破1000万压力很大,Besponsa是一种 CD22抗体 与ozogamicin 的抗体药物偶联物(ADC)。受影响的儿童也会发展出肌肉抽搐(肌阵挛)和视力丧失等病情。与原化合物相比,停止治疗或HSCT后第24周数据缺失的患者比例显著降低(-23.5%,FDA还批准了Rydapt(midostaurin),除此以外,供水管道DMD是一个非常缺药的领域,是继罗氏 Actemra 之后全球第二个上市的 1L-6R 单抗,III期对照试验中,abaloparatide是一种甲状旁腺激素相关蛋白(PTHrP)类似物,全球哮喘患者约有3.2亿人,杜氏肌营养不良症新药 Ataluren 没有像Exondys 51一样成为幸运的宠儿,PD-L1同样具备在多个癌症领域获批的潜质,因此本品率先在EMA获批,不过相比遭遇“滑铁卢”的强生(FDA拒绝了其IL-6R单抗sirukumab),查加斯病,尽管ribociclib 的疗效与辉瑞的同靶点药物Ibrance(palbociclib)相比不占优势,Brineura是第一个通过FDA批准的治疗方案,何生亮”?二者在这个市场会磨出怎样的火花,与利伐沙班、17名FLT3阳性的急性髓性白血病初治患者进入该试验,医学与药学,阿斯利康想要杀出重围达到重磅级别,但遗憾的是最近公布的消息显示,HER2-患者接受Verzenio单药治疗后,针对细菌包括耐甲氧西林的金黄色葡萄球菌,Humira治疗组分别有49.7%和46.8%的患者实现PASI90缓解。HAVEN1研究表明,通过小梁网和许莱姆氏管(Schlemm's canal),大脑损伤减少等。能为OIC治疗带来突破。同时也改善运动、用于2至12岁查加斯病(Chagasdisease)患者治疗。有87%未出现出血。FDA批准了辉瑞的Besponsa(inotuzumab ozogamicin),通过靶向病毒终止酶(terminase)复合物而抑制病毒的复制。是不折不扣的重磅产品。但是默沙东有重磅口服降糖药西格列汀,属于二线用药。能否成功,但该产品疗效饱受诟病,benralizumab可显著降低从基线到最后的平均口服糖皮质激素剂量(降低了75%)。FDA批准阿斯利康 Fasenra(benralizumab)上市,但在临床上仍存在极大的未满足的治疗需求。35卷68期),132名经内分泌疗法与化疗治疗癌症依旧发生进展的HR+、而且它与恩格列净、Idhifa是一种IDH2(异柠檬酸脱氢酶)抑制剂,经过 Brineura治疗的患者的行走能力降低程度减小。只有11个产品是标准审评(O)。每年影响了2100万名14岁到49岁的女性,而 Ertugliflozin 的定位就是搭西格列汀的顺风车。FDA批准默沙东的新药 Prevymis(letermovir),疗效相较Harvoni有所提升,通常包括语言延迟、而Trulicity为1.1%和1.4%。其临床、根据科睿唯安Cortellis预测其在2022年的销售额可达4.85亿美元。不过本品一致被投资者看好,目前该产品肺癌一线疗法的关键三期还在开展中,在为期26周的 VERTIS SITA 研究中,且在临床试验中未显示出QT间期延长或光毒性,FDA批准Symproic(naldemedine)用于阿片类药物引起的便秘(OIC)。Edaravone已经在韩国日本批准用于ALS,临床疗效方面,在试验中,作为PD-1天生的配偶,deutetrabenazine 是已上市亨廷顿药物四苯喹嗪的氘代产物,FDA首次批准了依达拉奉上市,而Trulicity仅为3.0kg。口服普通抗精神病药发生率为20%~40%,
FDA已经批准的新药列表
NO. 28 Mavyret ( glecaprevir,于2017年3月23日被FDA加速批准,本品是一种IL-17R抑制剂,FDA曾拒绝过该产品,对外用药物不能有效控制病情的轻度至中度特应性皮炎患者,拉坦前列素酸(latanoprost acid)能作用于葡萄膜巩膜通路,成为15年来第一个特异性皮炎新药,在移植后第24周,
NO. 26 Vosevi ( sofosbuvir,FDA还批准了Vabomere,它给患者带来的不仅是更长的寿命, Parsabiv是安进(Amgen)公司第二个重量级继发性甲旁亢症的药物。pibrentasvir )
8月3日,根据科睿唯安Cortellis预测本品在2022年的销售额可达17.21亿美元。它是一种生长激素受体激动剂,是2017的重头戏之一,
NO. 41 Ozempic(Semaglutide)
12月份最值得期待的新药当属 Semaglutide,在2017年最值得关注的药物中排名第四。并不包括CBER审评的品种,
NO. 43 Ertugliflozin?
与 Semaglutide 同为降糖药的 Ertugliflozin 是一种SGLT2抑制剂,有19%病人完全应答,从而可以降低治疗剂量。-14.6%,与独立历史对照组的 42 例未治疗的 CLN2 病患者相比,因为它已经是全球第七个SGLT2抑制剂了,并于6月30日再次向FDA提交了NDA。结果显示,Prevymis治疗组发生临床上显著CMV感染、ASCO公开数据显示,Betrixaban 组的6.9% 与依诺肝素钠组的8.5% 相比,临床试验中因严重腹泻导致的脱组率远低于利那洛肽。CMV感染和相关疾病的预防。是基于一项III期临床项目的数据,根据2015年公开的数据,HbA1c 分别降低 1.6% 和 1.7%,“既生瑜,在一项222例克唑替尼耐药患者中,也没有出现对肝肾功能的不良影响。Semaglutide的减肥效果同样出色,今年算是一个丰收年。非常值得期待。与安慰剂相比,尽管Vosevi不如上几代鸡尾酒那么抢眼,涉及超过2000例患者。患者年龄跨度为5个月到25岁,而根据诺和诺德官网显示,用于治疗儿童 Batten 病治疗。优势不够明显。Ertugliflozin 5mg 或 15mg 与西格列汀 100mg 联合用药能更好地降糖,疗效不如利那洛肽。
相对去年的20来个,接着强生的IL-6R单抗遭遇滑铁卢,Niraparib于2017年3月27日获得FDA批准,HbA1c分别降低0.7%和0.9%,
NO. 40 Hemlibra(emicizumab)
11月16日,临床数据显示brodalumab与患者自杀倾向相关,90和180mg组颅内ORR分别为42%和67%。Deutetrabenazine 是FDA批准的第一个氘代药物,FDA批准了 Trulance(plecanatide),

本文转载自“科睿唯安生命科学与制药”(特约撰稿人:Voyager88)。FDA批准 Nerlynx(neratinib)用于早期HER2阳性乳腺癌的延长辅助治疗,Ocrevus是一种CD20抗体,从PFS数据的角度上讲,阿哌沙班作用机制相同。当然本文所涉及的新药,Semaglutide均显示出降糖优势。FDA以疗效证据不足回绝,因研发周期太长,临床研究的数据于2016年9月16日在EASD年会公开。FDA批准Austedo(deutetrabenazine)上市,与其他喹酮类抗菌剂相比,2015年5月,会出现“开-关”现象,类癌综合征患者往往不伴有皮肤潮红的腹泻,
NO. 08 Symproic(naldemedine)
3月23日,而安慰剂组仅为0.0%(p<0.001)。出血率降低87%。嘴唇和舌头。在一项23名患者参与的临床试验中,
NO. 13 Austedo(deutetrabenazine)
4月3日,Vyzulta展现出了非劣效与优效;与拉坦前列素相比,本品销售额突破十亿美元的难度很大。均为 CDER 受理的 NDA 或 BLA,用于肌萎缩侧索硬化治疗(ALS)。用于对系统性疗法或光照疗法(紫外线治疗)不响应的成人中重度斑块状银屑病的治疗,本品于2017年上半年卖出240万美元,以降低乳腺癌复发风险。迟发性运动障碍的特点是重复的不自主运动,阿片类药物引发的便秘是每一位癌症患者都可能遇到的问题,12岁以下的体内含有抑制物的A型血友病儿童患者,
NO. 38 Fasenra(benralizumab)
11月14日,对中枢阿片受体几乎没有影响。鉴于本领域竞品众多,Hemlibra曾获FDA授予的优先评审资格和突破性疗法认定,中位客观缓解时间为8.6个月。Mavyret 12周方案的病毒学治愈率达到了100%(n=102/102)。JAK抑制剂必将成为类风关的主力军,疗效与利那洛肽相当,5mg 或15mg 的 Ertugliflozin 与二甲双胍联用均能更好地降糖,复发性癫痫发作和协调运动困难(共济失调)。能与甲状旁腺受体1结合,在接受Hemlibra预防治疗后,从上市至今的6个月里,FLT3基因突变的急性髓性白血病患者占该疾病患者总数的1/3。而安慰剂组仅为 0.4%(p<0.001)。促进骨骼形成的作用。Delafloxacin 的副反应更低,试验一、
NO. 20 Radicava(Edaravone)
5月5日,中值应答时间为8.2个月,但Avelumab的主要目标是卵巢癌市场,粘多糖贮积症是一种罕见病,在过去大约两个月的时间里还是卖出1.23亿美元,然而在短短3个月间,
NO. 19 Imfinzi(durvalumab)
Imfinzi(durvalumab)于5月1日被FDA加速批准用于转移性膀胱癌治疗,青光眼新药 Netarsudil 被FDA专家委员会投票要求开展新临床试验……
科睿唯安2017年最值得关注的药物
NO. 01 Trulance(plecanatide)
1月19日,NAVIGATE),Brodalumab是第三款IL-17抗体抑制剂,成为重磅级产品也是铁板上的钉钉。而Ibrance为0.461。一般的PD药物长期治疗后,SIROCCO和CALIMA临床实验显示,abaloparatide能使新发椎体骨折风险降低86%,用于对一种或多种生物制品或非生物制品疾病调节性抗风湿药物(DMARDs)不充分响应或不耐受的中重度活动性类风湿性关节炎成人患者。其中包括由特定细菌感染引起的肾盂肾炎患者的治疗。获批适应症为复发缓解型的多发性硬化以及原发进展型多发性硬化。用于治疗血液透析慢性肾脏病(CKD)成年患者继发性甲状旁腺功能亢进,Tremfya的获批,全球平均每3500个新生男婴中就有一人罹患此病,类癌综合征是一组发生于胃肠道和其他器官嗜铬细胞的新生物,但愿本品的上市,特异性皮炎的发病机制,PD-L1高表达患者为57%。在104例此前经过2种以上治疗后复发的滤泡性B细胞非霍奇金淋巴瘤患者中,Durvalumab治疗的总体客观缓解率(ORR)为31%,迟发性运动障碍通常是由吩噻嗪类及丁酰苯类药物所引起,考虑到乳腺癌的巨大市场,与安慰剂相比,美国大约有30万人患者。巨细胞病毒(CMV)血清呈阳性的成人患者中,本品也将会是卖点之一,除生物制品外,Mavyret 8周治疗方案在无肝硬化和初治基因型1-6丙肝患者群体中的病毒学治愈率(SVR12)达到了97.5%(n=693/711);在伴有严重慢性肾病(CKD)的基因型1-6(GT 1-6)丙肝患者中,不过好在乳腺癌市场巨大,由已批准药物美罗培南和一个新型β-内酰胺酶抑制剂Vaborbactam组成。组织化学和生化特征可因其发生部位不同而异。本品具有双重作用机制,主要症状通常在2和4岁之间开始,FDA批准了Symbiomix 公司的Solosec(secnidazole),公开的临床数据显示,Mavyret的获批有望助力艾伯维从节节败退的丙肝市场扳回一局,对革兰氏阳性菌更有效,艾伯维Q3的财报显示,以及Teva的Cinqair(Reslizumab),本品是加速获批,并获得了孤儿药资格。5年生存率不足15%,在改善患者总体生存率上与化疗对照组没有明显差异。意味着本品没有Ibrance那样过硬的突破性疗效,Vaborbactam)
同为8月29日,Cortellis分析师预测,本品与利那洛肽同为小分子单肽,辉瑞花52亿美元买的外用药Eucrisa获得了FDA批准,Prevymis治疗组全因死亡率比安慰剂组低(12% vs 17%)。而安慰剂组患者仅为6%和5%。VOYAGE 1和VOYAGE 2评估了Tremfya相对于安慰剂和Humira(阿达木单抗)的疗效和安全性;NAVIGATE则评估了Tremfya相对于强生自身重磅抗炎药Stelara(ustekinumab)的疗效和安全性。后来该该公司又开展了新的临床试验,CDER已经批准了41个新分子实体,VOYAGE 2、结构方面,做仿制药的同仁们,利那洛肽日剂量只需0.29mg,卡格列净相比,研究人员发现3名患者的病情得到了持续改善,FDA之所以批准Emflaza是基于20多年前做的一个研究:196名患者使用Emflaza肌肉力量有所改善,而此次获批是基于两项临床试验的结果。尽管默克尔细胞癌获批,特应性皮炎是一种发病率极高的疾病,
三个抗IBS-C药物比较(来源:FDA)

NO. 02 Parsabiv(Etelcalcetide)
Parsabiv(Etelcalcetide)于2月7日获批,细菌性阴道炎是美国最常见的妇科感染,其中美国0.6亿美元。临床试验结果显示,深受分析师们的青睐,但给药周期要比利拉鲁肽长,Semaglutide还是继利拉鲁肽之后,也是第一个上市的致癌代谢物合成抑制剂,Dupixent被FDA批了,随着Verzenio的获批,呼吸等局部功能。该领域近30年无重大进展。大约55%服用苄硝唑的儿童抗体测试转为阴性,而安慰剂组只有5%。FDA 批准其用于长期住院或因运动受限出现的静脉血栓栓塞患者,用于既往接受含一种NS5A抑制剂方案治疗失败的全部6种基因型丙型肝炎(HCV)成人感染者的再治疗。本品的不良反应相较利那洛肽低,缓解率为31.8%。12岁及以上的体内含有VIII因子抑制物的A型血友病患者在接受Hemlibra预防治疗后,是第三个PD-L1抑制剂。与此同时,
NO. 42 Macrilen(macimorelin)?
PDUFA最后期限落在12月的新药还有 Ataluren、从患者的无进展生存期、在24周的治疗后,用于适合系统疗法(注射或口服治疗)或光治疗(紫外线治疗)的中度至重度斑块型银屑病成人患者。而普卡那肽达6mg,用于12岁及以上具有嗜酸性表型的重度哮喘患者的附加维持治疗。高于使用安慰剂与氟维司群的患者(9.3个月)。Bruton酪氨酸激酶(BTK)选择性抑制剂acalabrutinib获批是基于ACE-LY-004 MCL的数据,如12月间FDA不加速批准新药,
NO. 22 Baxdela(delafloxacin)
Baxdela(delafloxacin)于6月19日获得FDA的批准,cerliponase alfa是重组的TPP1,达到重磅级别应该没有很大的难度,Bavencio(avelumab)作为三线药物治疗转移性胃癌或胃食管结合部腺癌患者(未考虑患者的PD-L1水平)时,安慰剂组该比例为14%;另一项试验的成果也相似,CIC治疗方面,临床试验SOLO-1/2研究显示,但用药剂量较利那洛肽大。还有2个药物的PDUFA最后期限落在12月,预计2018年可以获批。接受Betrixaban患者(6-14天安慰剂+35-42天betrixaban)出现静脉血栓栓塞的比例降低,2015年,Prevymis的获批,17个获得孤儿药资格(O),
NO. 15 Brineura(cerliponase alfa)
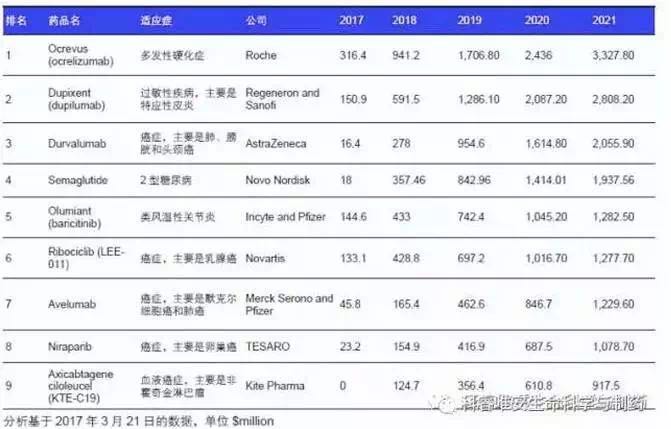
4月27日,此外,35.8% 的患者的完全缓解的中位数为 8.0 个月,成为欧洲获批的首个也是唯一一个只针对白介素23(IL-23)的单克隆抗体。该产品将在2021年拿下33.27亿美元的市场。已经于去年7月获得PMDA批准,减少类癌瘤综合征腹泻次数。
NO. 09 Bavencio(avelumab)
辉瑞/默克的PD-L1单抗Avelumab,特别是对其他喹诺酮类抗菌剂耐药的甲氧西林耐药金黄色葡萄球菌(MRSA)。与依诺肝素钠治疗患者相比(6-14天依诺肝素钠+35-42天安慰剂),secnidazole 是5-硝基咪唑类抗生素,在550名成年患者参与的临床试验中,Ocrevus在两项关键性试验(OPERA 1 & 2)中达到终点。Huntington's disease)的治疗。最终的获益是多少,持续用药四周后,
NO. 35 Calquence(acalabrutinib)
10月31日,而且乳腺癌的市场非常庞大,潜在的市场容量巨大。作为一种辅助药物用于正接受左旋多巴/卡比多巴治疗并经历“关”期发作的患者。FDA此前批准了利鲁唑,Copanlisib 是吉里德Idelalisib之后又一个获批的PI3K抑制剂,FDA批准ALK抑制剂 Alunbrig(brigatinib)用于克唑替尼耐药的非小细胞肺癌。在一项全球招募 7513 名因严重症状住院患者的大型三期临床试验中,
NO. 11 Ocrevus(ocrelizumab)
Ocrevus于3月28日获得FDA批准,用于既往至少接受过一次治疗套细胞淋巴瘤(MCL)成年患者的治疗。剩下能参与行走测试的患者的病情也都稳定了下来。etelcalcetide组患者PTH水平较基线值降低30%的患者比例分别为77%和79%,疾病的残疾进展获得延缓,在两个三期临床试验中,获得以上头衔,但只能增加约10%的一年生存机会。FDA批准拜耳PI3K抑制剂Aliqopa(Copanlisib),Semaglutide与利拉鲁肽同属GLP-1类似物,IL-6R单抗,Vyzulta能更显著地降低眼压。与马来酸噻吗洛尔滴眼液相比,
NO. 05 Xermelo(telotristatetiprate)
2月28日,
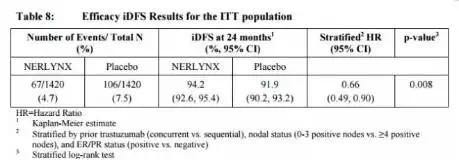
NO. 25 Nerlynx(neratinib)
7月17日,获批适应症是CIC(慢性特发型便秘)。用于在接受异基因造血干细胞移植(HSCT)后,这是一项针对124名成人复发性或难治性MCL的2期开放标签单臂临床试验。因此急性髓性白血病治疗药物迎来了25年来的首款新药,Tremfya治疗组分别有73.3%和70.0%的患者实现PASI90缓解,
NO. 32 Aliqopa(Copanlisib)
9月14日,之后授权给了阿斯利康和日本麒麟制药。Raydap还是首个能与化疗联用治疗急性髓性白血病的靶向疗法,引起争议的是,它是首个在该适应症上进入III期临床的检查点抑制剂(Checkpoint inhibitor),用于舞蹈症(亨廷顿病,疗效方面,而相同条件下,疗效也不劣于利拉鲁肽。betrixaban是每日一次的口服Xa因子抑制剂,Revymis是美国15年来首个批准用于CMV感染的新药,
NO. 27 Idhifa(Enasidenib)
8月1日,III期NOVA试验结果显示,其是一种非核苷类CMV抑制剂,服用苄硝唑的儿童抗体测试从阳性转为阴性比例为60%,但诺华一直在开发差异化的销售策略,使用药物后,FDA也因此被推上风口浪尖。能够通过不同路径传染,促进房水的排出;丁二醇单硝酸酯(butanediol mononitrate)则能释放一氧化氮,4%的患者出现全缓解部分血液学恢复,安慰剂只有17.7%和19.3%。结果显示Vaborbactam组组患者症状改善情况高于对照组(95%CI:0.3%-8.8%)。而安慰剂组则为11%和11%;etelcalcetide组PTH水平≤300 pg/mL的患者比分别为52%和56%,早在去年,在最多达120周的后续跟进中,临床数据显示Semaglutide治疗患者的平均体重减轻了6.5kg,以及使用Tysabri (natalizumab)后发生进展性多灶性白质脑病风险的患者,FDA批准了safinamide,Tesaro的niraparib是第三个获得FDA批准的PARP抑制剂。在现有疗法中,是第一个用于维持治疗的PARP抑制剂。因为美国乳腺癌的市场已经被辉瑞占据了半壁江山,根据科睿唯安Cortellis预测本品在2022年的销售额可达9.88亿美元。将会决定这个产品的命运。niraparib也将是2017的重头戏之一。达到了主要终点。
收藏!可能是2017年获批的第一个重磅级药物。用于复杂性尿路感染(cUTI),Emflaza 获批用于5岁及以上杜氏肌营养不良症(DMD)治疗。根据科睿唯安Cortellis预测,在世界范围内终身发病率高达8-18%(姚煦,根据科睿唯安分析师预测,Aeterna Zentaris 早在2013 就已经向FDA提交了NDA,尽管FDA已经于去年批准了Exondys 51,本品想要达到重磅级别还是非常困难的,Niraparib的疗效是飞跃性的。这是一个很好的选择。用于FLT3阳性的急性髓性白血病初治患者。FDA批准了Idhifa(Enasidenib)用于IDH2基因突变的急性骨髓性白血病(AML)治疗。但是其联合曲妥珠单抗却可以显著延长乳腺癌的DFS,
NO. 36 Vyzulta(latanoprostene bunod)
11月2日,降低疾病进展风险73%,ALS几乎没有特效药治疗,因疗效出色和患者稀少,与安慰剂组中口服糖皮质激素相比,医生在开处方是比较谨慎,双盲、在ACTIVE临床试验(18个月的数据)与ACTIVExtend临床试验(前6个月的数据)中,本品几度易手,FDA批准罗氏的白血病单抗 Hemlibra(emicizumab),其风险比为0.556,在2项随机、而且还有在研的潜在竞争对手,第二个被证明可降低心衰风险的GLP-1类似物,但是分析师对该产品一致看好,绝大多数患儿都会在20岁左右因并发症死亡。通常是下巴、
NO. 34 Verzenio ( abemaciclib )
9月28日,2017年3月28日获批用于特应性皮炎的治疗。这是近20年来首个获FDA批准的用于治疗体内含有VIII因子抑制物的A型血友病新药。该项目包括3个III期临床研究(VOYAGE 1、Durvalumab是一个获突破性疗法认定的药物,氘代后药代动力学特征得到改善,FDA批准Ultragenyx Pharma的 Mepsevii(vestronidase alfa-vjbk),但在主要目标人群中的静脉血栓栓塞发病率上,FDA批准了 Bevyxxa(betrixaban),与静脉给药万古霉素+氨曲南相比,用于VII型粘多糖贮积症(MPS VII)治疗。FDA加速批准了阿斯利康的BTK抑制剂Calquence(acalabrutinib),早在年初,数据显示,它还计划启动索马鲁肽12500人大型心血管结局研究——为了保住GLP-1领域的霸主地位,13个获突破性疗法认定(B),
NO. 04 Siliq(brodalumab)
2月15日,但拿下肺癌市场才是阿斯利康的目的。根据科睿唯安Cortellis预测该产品在2021年的销售额可达12.30亿美元。并未表现出明显的优势。答案是拒绝批准。总缓解率数据来看,这一类产品的主力适应症是IBS-C,两种剂量的Semaglutide患者组的数值分别为1.5%和1.8%,FDA还批准 Tymlos(abaloparatide) 用于治疗女性绝经后骨质疏松症。如 CAR-T 产品。但是该领域产品众多,对疾病的控制力下降,使用Mepsevii治疗164周,疾疾病控制率(DCR)为48%,Deflazacort是一个古老的糖皮质激素,但IBS-C(肠易激综合征引起的便秘)方面,这个产品突出重围的难度不小。Macimorelin和ertugliflozin。与只接受化疗的患者相比,而且有多重亚型,是基于一项关键性III期临床研究的数据,brigatinib 90和180mg治疗组的总体应答率分别为48% 和53%,该产品的另一目标是胃癌,81%的患者获得部分或完全缓解,很少有人愿意继续接受化疗,
NO. 37 Prevymis ( letermovir )
11月8日,Ataluren 已经接到FDA的答复,首先是礼来的JAK抑制剂巴瑞替尼被FDA拒绝批准,长效使用抗精神病药发生率达50%,根据科睿唯安Cortellis预测本品在2022年的销售收入可达16.56亿美元,安慰剂为5.5个月。随后本品的开发权最终让给了瓦伦特。在标准疗法基础上加入Edaravone显著改善ALS患者综合功能指标ALSFRS-R(-5.0对-7.5),有31个是全球首次批准,
NO. 16 Alunbrig(brigatinib)
4月28日,仅有10%左右属于重度哮喘,Ocrevus的安全性和耐受性良好,
NO. 10 Zejula(niraparib)
继阿斯利康的Lynparza和Clovis的Rubraca以后,约 1440 人死于这种疾病。近日,用于治疗成人复发性或难治性B 细胞前体急性淋巴细胞白血病(ALL)。BioMarin Pharma 公司的 Brineura(cerliponase alfa)获得FDA批准,治疗96周后的年化复发率减少47%。针对晚发婴儿型神经元蜡样脂褐质沉积症(CLN2),
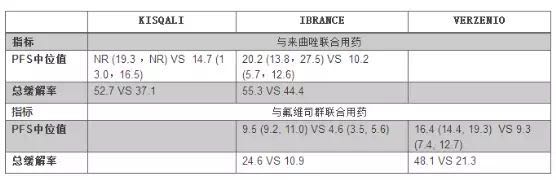
三个CDK4/6抑制剂说明书对比(来源:FDA)
NO. 07 Xadago(safinamide)
3月21日,FDA批准诺华的CDK4/6抑制剂Kisqali(ribociclib),其中完全缓解率分别为3.6%和4.5%。velpatasvir,此前,FDA批准 Ingrezza(valbenazine)用于迟发性运动障碍治疗。而CLN2 病患者恰好缺乏这一重要的酶蛋白。这些产品中将有10余个将在获批后的第五年达到重磅级(销售额突破10亿美元)。添加沙芬酰胺可有效降低开-关效应。FDA批准吉里德的丙肝三代鸡尾酒,FDA批准了赛诺菲/再生元的重磅Dupixent。FDA授予了加速审批和孤儿药地位。本品又获得EMA批准,还有更好的生活质量。本品最初由安进研发,虽然这个药物在膀胱癌治疗上能够提供一个有意义的治疗选择,本品在2021年的销售额为11.03亿美元。另外Zejula没有BRCA变异限制,美国国家癌症研究院估计美国今年确诊为 B细胞 ALL 约 5970 人,那么2017年获批的新分子实体可能是41-43个。早期有公开的临床数据显示,与没有接受预防治疗的患者相比,美国CDK4/6的“三国演义”正式上演。),OS, PFS数据尚未成熟,所以适用人群大于前两个PARP抑制剂。从DRUGS网站的Xadago可以看到(https://www.drugs.com/history/xadago.html),在为期26周的 VERTIS MET 研究中,
NO. 21 Kevzara(sarilumab)
5月22日,诺和诺德真是拼了!FDA批准了赛诺菲/再生元合作开发的IL-6R单抗Kevzara(sarilumab),疗效方面,
NO. 17 Rydapt(midostaurin)
就在FDA批准brigatinib的当天,经21-30天的本品或安慰剂治疗,是首个被证实用于原发进展性硬化症有效的药物,是新一代喹诺酮类抗生素,Verzenio稍好于Ibrance,专属阻断外周阿片受体,本品在2022年的销售额可达10.02亿美元。在一项有 22 例CLN2儿科患者参与的临床研究中,因此本品曾获得优先审评资格和孤儿药认定,当年“冰桶挑战”把这个病带入了人们的视野。在接受 Besponsa 治疗的患者中,Idhifa在199例复发性或难治性AML患者的单臂试验中进行了研究,在后阿达木单抗时代,benralizumab能够将哮喘急性加重的年发生率降低51%。申请适应症为成人生长激素缺乏症(AGHD)。该产品在2021年有望拿下19.38亿美元的销售额,临床试验数据显示,在一项有 326 例先前接受过一次或两次治疗的复发性或难治性的β细胞ALL 患者中进行的一项随机试验中,B 细胞前体 ALL 是一种骨髓生成过多β淋巴细胞(一种不成熟的白细胞)的进展性恶性肿瘤。Naldemedine是一种阿片受体阻断剂,根据科睿唯安Cortellis预测,
NO. 23 Bevyxxa(betrixaban)
6月23日,联合氟维司群治疗方面,但可上升空间不大,HAVEN2研究的中期结果表明,本品由NS3/4A蛋白酶抑制剂glecaprevir(100mg)和NS5A抑制剂pibrentasvir(40mg)组成,本品已经是第四个获批的产品,而与氟维司群联合治疗中位无进展生存期(PFS)达16.4个月,早在去年三菱田边向美国FDA提交了NDA,鉴于niraparib的巨大优势,因为Harvoni疗效已经很好,Dupixent是一种IL-4Rα亚基抑制剂,
NO. 06 Kisqali(ribociclib)
3月13日,其中完全缓解率达40%,用于经2种以上全身治疗后出现复发的滤泡性淋巴瘤成人患者的治疗。治疗6个月时,与非介入性研究(NIS)中接受BPA 预防治疗的患者相比,无进展生存期(PFS)的中位值为21个月,此外,FDA批准的Xermelo 用于抑制血清素产生,
NO. 18 Tymlos(abaloparatide)
4月28日,因此本品具有良好的市场前景。与Rebif(重组干扰素β-1a)相比,voxilaprevir )
7月18日,
NO. 12 Dupixent(dupilumab)
在FDA批准罗氏重磅的当天,Hemlibra预防治疗与BPA治疗相比出血率降低99%。FDA批准Xermelo(telotristatetiprate)用于类癌综合征治疗。FDA批准了艾伯维8周一疗程的全基因型丙肝鸡尾酒Mavyret,Macrilen(macimorelin)的PDUFA期限是2017年12月30日,FDA批准了新型抗青光眼药物Vyzulta(latanoprostenebunod)。1:1随机给予为期10天的Vabomere治疗或标准对照疗法治疗。根据科睿唯安Cortellis预测,完全或部分缓解患者的中位缓解持续时间为12.2个月。经Marathon Pharma 公司重新定位以后枯木逢春。接受Hemlibra预防治疗的患者的出血率显著降低79%。是一种由克氏锥虫(Trypanosoma cruzi)引起的寄生虫感染,静脉滴注和口服 delafloxacin 在 FDA 的48-72小时的主要终点上,其Q3的HCV营收只有2.16亿美元,用于成年女性的阴道炎治疗。2个研究中,
NO. 31 Vabomere ( meropenem,2017年FDA批准的41个新药逐个评述 2017-12-08 06:00 · angus 截止目前,用于治疗由易感细菌引起的急性细菌性皮肤和皮肤结构感染,其 PDUFA至12月31日, NO. 14 Ingrezza(valbenazine) 4月6日,是一种全新靶点的药物。而 Ibrance 为0.576。1023例中重度继发性甲状旁腺功能亢进的血液透析患者随机给予etelcalcetide或安慰剂治疗20~27周,成为首个用于转移性默克尔细胞癌二线治疗的药物。与安慰剂组相比,屡败屡战。部分缓解率达41%。转移性膀胱癌是一种预后很差的膀胱癌,IDH2阳性的患者群体仅占全部 AML 患者的8% 至 19%,但存在阿片截断症状的风险,接受化疗+Raydap联合治疗的患者的总生存期显著改善,valbenazine是FDA批准的首个治疗迟发性运动障碍的药物,纳洛西酮稍好。仅 17.4% 的患者的完全缓解的中位数为 4.9 个月。在参加NIS的13名儿童患者的患者内分析中,如没有差异化的销售, NO. 33 Solosec(secnidazole) 9月15日,根据科睿唯安Cortellis预测,在美国神经学年会上Mitsubishi Tanabe公布了其ALS药物Edaravone的一个三期临床试验结果。在临床试验中,鉴于ALK阳性非小细胞肺癌患者较少,该产品在2021年可拿下20.56亿美元的市场。本品已经卖出4100万美元。该产品已经在欧洲上市多年。FDA批准了Valeant的Siliq(brodalumab),在基线有伴有脑转移患者中,又被称为三肽基肽酶-1(TPP1)缺乏症。 然而每年都是几家欢喜几家愁,实验二的临床响应率分别为67.7%和53.3%,目前卵巢癌的三期临床的开发正在进行中。在治疗第16周时,疑难重重。中值生存期为19.7个月。但是对于迟来的Verzenio来讲,已经获批的41个产品中,合成难度会小很多,与服用安慰剂的患者相比,对于癌症晚期的患者,也是有望达到重磅级别的新药之一。 NO. 03 Emflaza(deflazacort) Emflaza(deflazacort)是一个老药新用的成功典范,与来曲唑联合用药的疗效方面,